Generelt om vacciner mod covid-19
Her kan du læse om vacciner mod covid-19. Hvordan vaccinerne er blevet udviklet, hvordan de er blevet godkendt, og ikke mindst hvordan myndighederne nøje overvåger sikkerheden og bivirkninger ved vaccinerne.
genereltGodkendte vacciner
Her kan du læse mere om de vacciner mod covid-19, som er blevet godkendt i hele EU og som tidligere har fået en såkaldt betinget markedsføringstilladelse. Det europæiske lægemiddelagentur EMA har medio september 2022 indstillet til EU-Kommissionen, at vaccinerne fra Pfizer/BioNTech og Moderna begge får fuld markedsføringstilladelse. Indstillingen gælder både de eksisterende versioner af de to vacciner samt kommende variantjusterede udgaver.
Mere information om effekt, bivirkninger, resultaterne af forsøgene, der ligger til grund for at de blev godkendt, indlægssedlen, produktresuméet og spørgsmål/svar om vaccinen, kan du finde på denne side.
Disse to vacciner er godkendt i hele EU og indgår i det danske vaccinationsprogram mod covid-19:
To andre vacciner, der ligeledes er godkendt i EU, blev også anvendt i begyndelsen af det danske vaccinationsprogram men blev efterfølgende taget ud af programmet:
Information fra andre myndigheder
Den myndighedsfælles temaside coronasmitte.dk
Sundhedsstyrelsens temaside om vacciner mod COVID-19
Statens Serum Institut: Overvågning af COVID-19
Styrelsen for Patientsikkerhed: Sundhedsfare, beredskab og COVID-19
Nyheder om covid-19
Udvikling
Da pandemien brød ud i 2019 blev alle sejl sat til for at få udviklet vacciner hurtigst muligt uden at slække på kravene til dokumentation for effekt og sikkerhed.
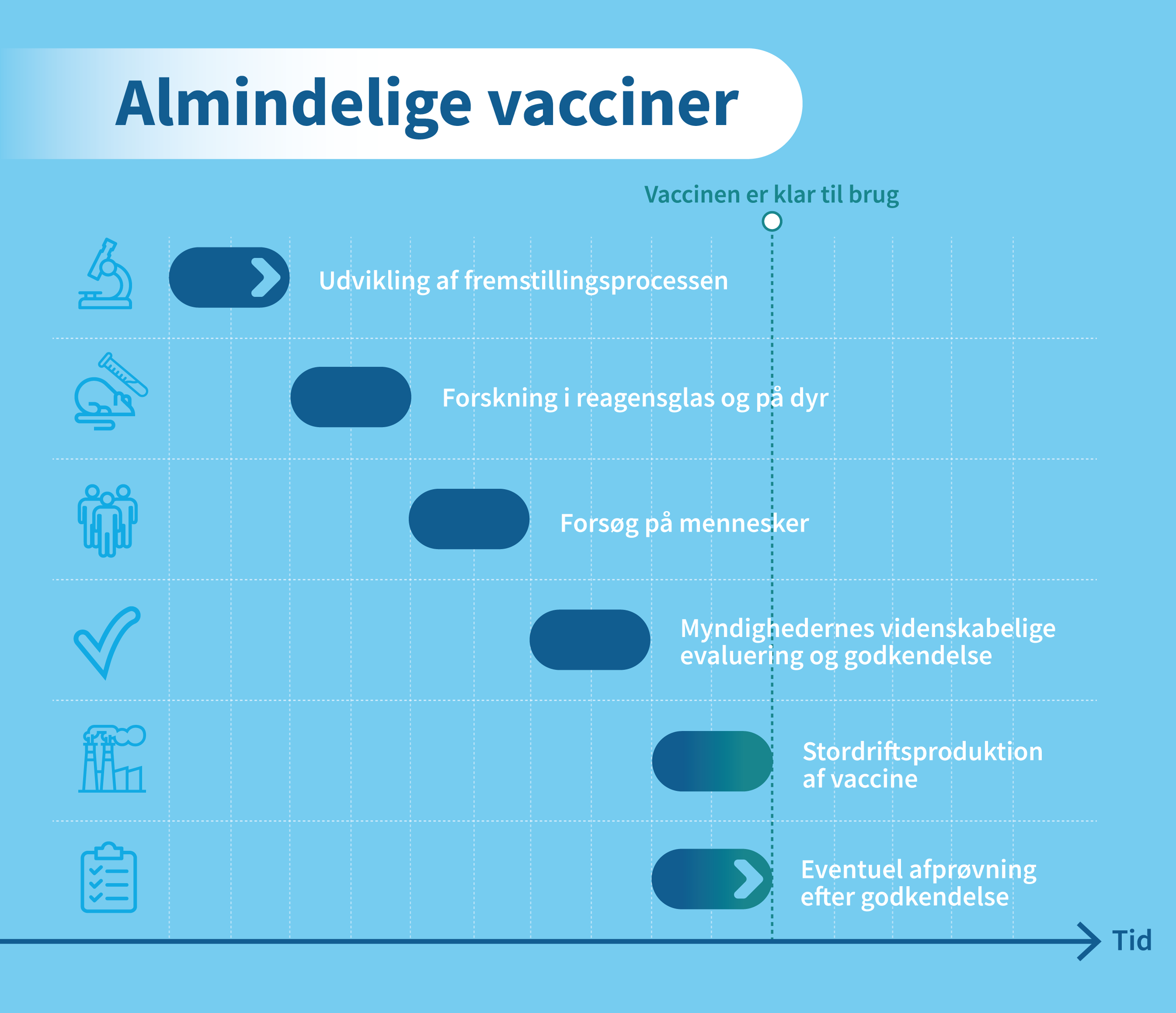
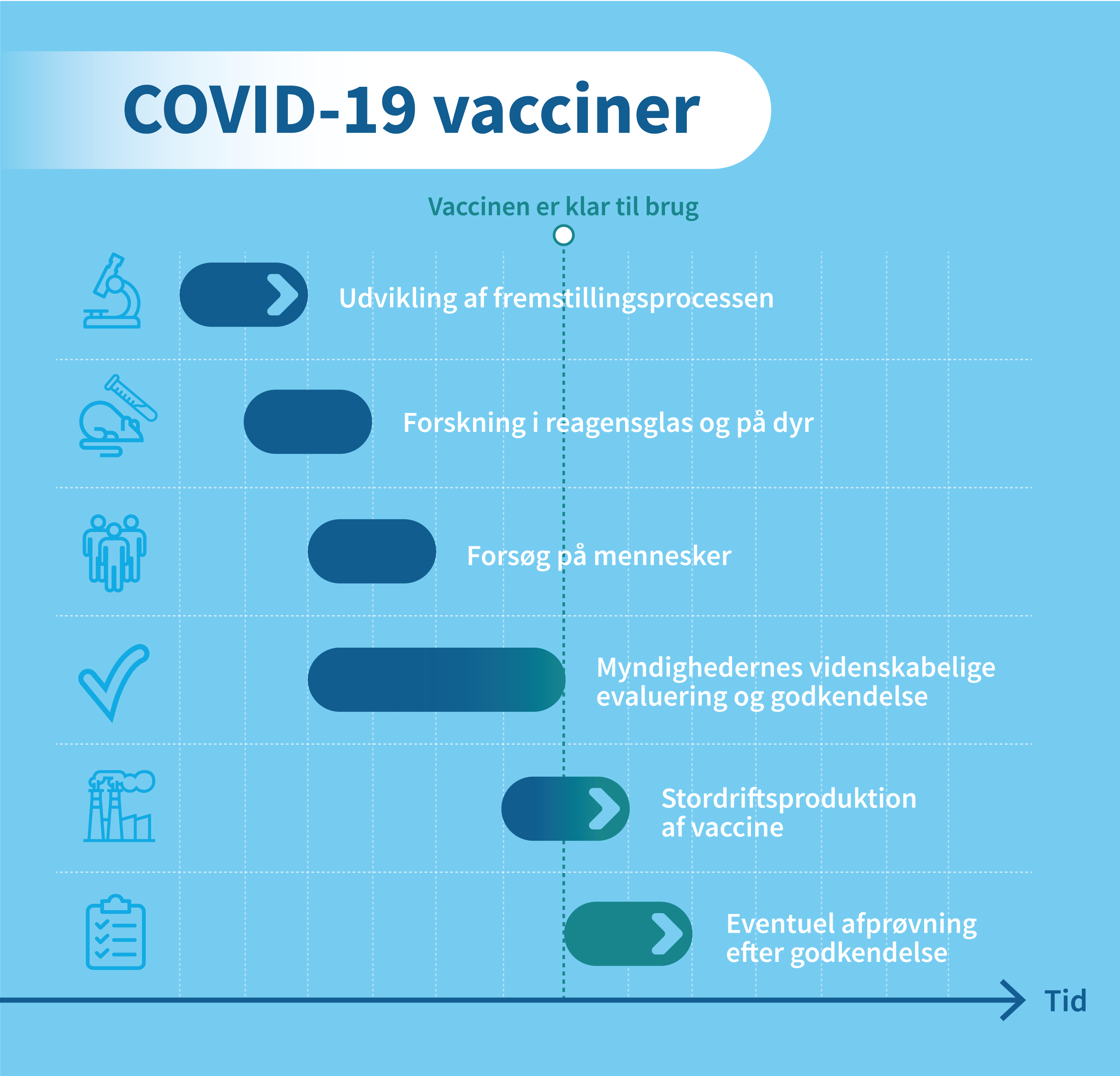
Vaccineudvikling er en kompleks, dyr og langvarig proces, der normalt kan tage op til ti år. På grund af covid-19’s påvirkning af vores samfund er udviklingen sket meget hurtigere end normalt.
Her kan du læse mere om udviklingen af covid-19-vacciner.
Udvikling i EU
Det Europæiske Lægemiddelagentur EMA har mobiliseret ekstra ressourcer og evalueret potentielle vacciner mod covid-19. Der laves løbende evalueringer – såkaldte rolling reviews – hvor myndighederne ser på dokumentationen fra virksomhederne, inden alle forsøg er afsluttet. På den måde kan en vaccine være klar tidligere end ellers. Læs mere om, hvordan coronavacciner vurderes med henblik på eventuelt at blive godkendt.
Det har været målet fra EU-landenes side med en fælles indsats at få udviklet, vurderet og evt. godkendt vacciner hurtigst muligt, vel at mærke efter de samme høje standarder og lovmæssige krav til lægemiddelkvalitet, sikkerhed og virkning, som gælder for alle andre lægemidler og vacciner.
Fra idé til godkendelse
Fra idéen om en vaccine opstår, til det første stik kan gives med en godkendt vaccine, er der en lang række ting, der skal afprøves. Der er forskellige faser i udviklingen af en vaccine, som forskere og virksomheder skal igennem, før vaccinen evt. kan godkendes.
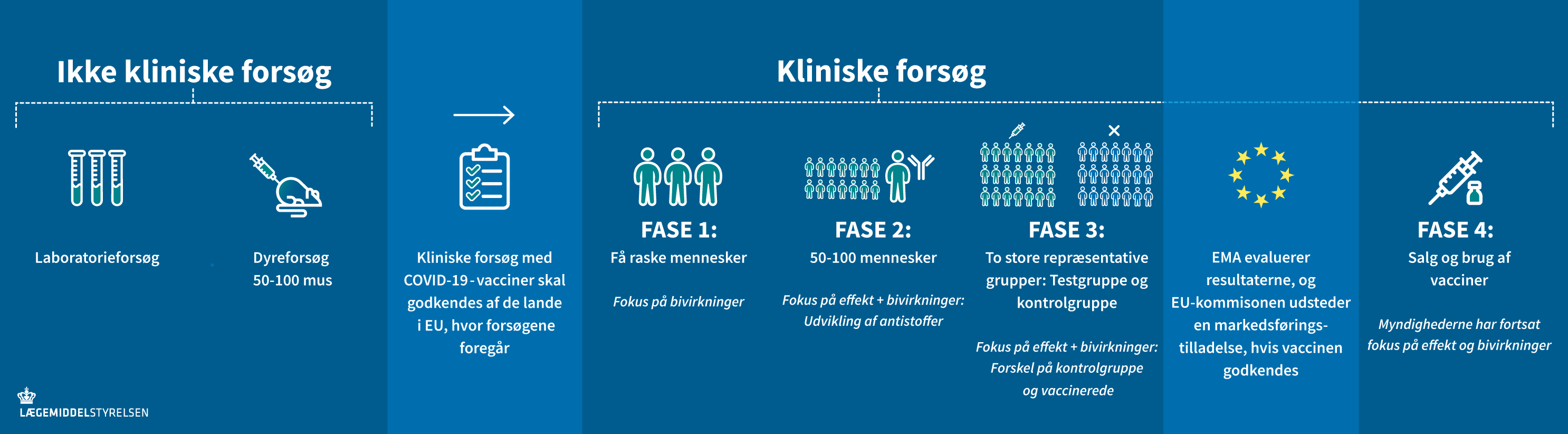
Forskerne skal først udvikle vaccinekandidaterne, som derefter skal afprøves i forsøg. Jo mere sikker man bliver på vaccinens effekt og bivirkninger, jo flere mennesker afprøves vaccinerne på. Læs mere om faserne i kliniske forsøg her. Fase 3-forsøgene med coronavaccinerne var meget store og involverede titusinder af forsøgspersoner verden over.
Godkendelse
Vaccineudvikling er en kompleks og langvarig proces, der normalt kan tage op til ti år. Men på grund af covid-19-pandemiens voldsomme påvirkning af verdenssamfundet har forskere over hele verden, vaccineproducenter og regeringer sat alle sejl til i en indsats uden fortilfælde for at udvikle vacciner mod covid-19 langt hurtigere end normalt.
Titusinder af forsøgspersoner har frem til godkendelsen testet vaccinerne mod covid-19 i forsøg verden over. Alle forsøgspersoner er blevet fulgt tæt under forsøgene, og der er efterfølgende fulgt op i mindst et år efter, forsøgene er slut.
I EU vurderer uafhængige fageksperter fra EU-landene, udpeget af de enkelte europæiske medlemsstater, dokumentationen fra vaccineproducenternes forsøg med nye covid-19-vacciner. Når EMA's ekspertgruppe CHMP (Committee for Medicinal Products for Human Use) er færdige med at vurdere en vaccinekandidat, indstiller EMA til EU-Kommissionen, at EU-Kommissionen godkender vaccinen og udsteder en betinget markedsføringstilladelse.
Efter en evaluering foretaget af CHMP, har EMA medio september 2022 indstillet til EU-Kommissionen, at vaccinerne fra Pfizer/BioNTech og Moderna begge får fuld markedsføringstilladelse – en indstilling som omfatter både de eksisterende versioner af de to vacciner samt kommende variantjusterede udgaver.
Løbende vurdering af forsøgsdata
EMA har iværksat en beredskabsplan, der bl.a. indebærer, at EMA’s fageksperter kan gennemgå dokumentationen for covid-19-vacciners effekt og sikkerhed hurtigt, uden at der slækkes på godkendelseskravene.
Det sker ved en løbende vurdering – en såkaldt ’rolling review’ – som betyder, at vaccineproducenterne indsender deres data til EMA til evaluering hos fageksperterne, så snart data er tilgængelige. I en normal godkendelsesprocedure indsender virksomheden alle data samlet, når alle forsøgene er færdige. Det betyder, at proceduren kan gennemføres på ca. 70 dage mod normalt 210 dage, fordi virksomheden ikke venter med at indsende alle data samlet til sidst, når alt er færdigtestet.
Fremskyndet godkendelsesproces for COVID-19-vacciner
Dokumentation
Producenterne har ansvaret for at udforme forsøg, så de giver tilstrækkelig dokumentation for vaccinernes effekt og bivirkninger. Vægten af dokumentationen afgøres bl.a. af antal forsøgspersoner og forsøgenes længde. Man følger også forsøgspersonerne efter godkendelsen.
Hvornår er dokumentationen af effekt og sikkerhed tilstrækkelig?
Det er op til vaccineproducenter at udforme vaccineforsøg, så de giver nok dokumentation til at vise, om en vaccine virker eller ej, og hvilke bivirkninger der kan være, så den kan godkendes af lægemiddelmyndighederne.
Hvis f.eks. en gruppe på 20.000 personer får vaccinen, og en anden gruppe på 20.000 personer får placebo, kan man sammenligne, hvor mange der smittes med covid-19 i hhv. gruppen med de vaccinerede og placebogruppen for at blive klogere på, hvor godt vaccinen beskytter mod smitte.
Det kræver et vist antal tilfælde af coronasmitte fordelt mellem de vaccinerede og de forsøgspersoner, der har fået placebo, for at man kan være tilstrækkeligt sikker på effekten af vaccinen.
Vaccineindhold
Vaccinerne mod covid-19 består af de beskyttelses- og hjælpeingredienser, der bevirker, at kroppen ’tænder for’ immunsystemet og producerer antistofferne, som kroppen anvender til at bekæmpe coronavirussen. Herudover indeholder vaccinerne stabilisatorer.
Beskyttelsesingrediensen består af mRNA. Ud fra vaccinens mRNA producerer kroppen det såkaldte spikeprotein. Det protein trigger derpå vores immunsystem, så det laver antistoffer mod den sygdom, som vi gerne vil bekæmpe – i dette tilfælde covid-19.
I det produktresumé, der følger med alle godkendte vacciner, kan du læse om de indholdsstoffer, der er i vaccinen – læs mere på www.produktresume.dk.
Vaccineteknologier

Som regel tager det mange år at udvikle nye lægemidler, men i forbindelse med covid-19-pandemien er det lykkedes at udvikle vacciner imod covid-19 meget hurtigt. Det har kunnet lade sig gøre, fordi vi på globalt plan var godt forberedt både i forhold til forskning og beredskab, da pandemien brød ud.
Gennem de seneste tyve år har der været en række andre alvorlige udbrud og pandemier af virussygdomme rundt omkring i verden. I 2002 blev 29 lande ramt af SARS-udbruddet, som også er en coronavirussygdom. I 2009 kom svineinfluenza-pandemien H1N1, som menes at have kostet op imod 200.000 mennesker livet, og efterfølgende var der MERS-udbruddet (også en coronavirussygdom) i Mellemøsten i 2012, Ebola-epidemien i Vestafrika i 2013-15 og Zika-pandemien, der ifølge WHO ramte 86 lande i 2015-16.
Rækken af udbrud har skærpet sundhedsmyndigheders og lægemiddelvirksomheders opmærksomhed på behovet for hurtigt at kunne etablere de nødvendige beredskaber og tiltag til at kunne kontrollere fremtidige pandemier. Der har ligeledes i årevis været fokus på at udvikle nye vaccineteknologier til brug imod nye, ukendte virussygdomme, og da covid-19-pandemien brød ud i december 2019, var der allerede erfaring med udvikling af vacciner imod lignende coronavirussygdomme (SARS og MERS).
Succes med nye vaccineteknologier
Flere af vaccinerne imod covid-19 er baseret på nye teknologier, der er blevet udviklet som en del af beredskabsindsatsen imod nye pandemier over de seneste 20 år.
Det gælder mRNA-teknologien, som vi kender fra Pfizer/BioNTechs og Modernas vacciner, der indgår i det danske vaccinationsprogram, og adenovirusvektor-teknologien, som bl.a. anvendes i vaccinerne fra AstraZeneca og Johnson & Johnson.
Disse teknologier var begge færdigudviklede, før covid-19-pandemien ramte, men har ikke tidligere været anvendt i godkendte vacciner – bortset fra en Ebola-vaccine baseret på adenovirusvektor-teknologien, som blev godkendt i USA i 2019 og i EU i 2020.
En af de store fordele ved mRNA-teknologien er, at man meget hurtigt kan opdatere vaccinerne til nye corona-varianter, uden at man skal udvikle en helt ny vaccine fra bunden.
Andre vaccineteknologier på vej
Der bliver løbende udviklet og godkendt flere nye covid-19-vacciner baseret på forskellige andre teknologier, for covid-19-pandemien er ikke overstået endnu, men forventes at ramme os i sæsonbølger fremover, ligesom vi kender det fra influenza.
Noget af det nye, vi kan forvente i fremtiden, er fx vacciner, der ikke kun beskytter imod sygdom, men også imod smitte. Samt vacciner, der giver en bredere krydsbeskyttelse, så de kan beskytte imod flere virusvarianter på samme tid, og kombinationsvacciner, der beskytter imod både corona og influenza. Der arbejdes også på at udvikle fx sprayvacciner og vacciner i tabletform, som kan være bedre at anvende til fx mindre børn og andre grupper, hvor det kan være en fordel at vaccinere på denne måde frem for at skulle give et stik.
De nye vaccineteknologier vil i fremtiden også kunne bruges over for andre typer virusudbrud og pandemier, og succesen med mRNA-teknologien baner desuden vej for udvikling af vacciner imod andre alvorlige smitsomme sygdomme foruden en række kræftsygdomme
Bivirkninger og overvågning af sikkerhed
Ligesom med al anden medicin kan covid-19-vacciner have bivirkninger. Det afgørende er, at de bivirkninger, vaccinen kan give, ikke må være værre end de symptomer og den sygdom, som vaccinen skal forebygge. Det er den afvejning, som Det Europæiske Lægemiddelagenturs uafhængige fageksperter kigger på, når de skal vurdere, om vacciner kan godkendes.
Hvis du bliver vaccineret mod en sygdom, er det almindeligt, at du kan opleve bivirkninger som f.eks. ubehag og rødme ved indstiksstedet, feber og muskelømhed. I sjældne tilfælde kan der opstå alvorlige bivirkninger. Myndighederne holder nøje øje med vaccinernes sikkerhed både før, under og efter, at de godkendes.
De kendte bivirkninger ved en godkendt covid-19-vaccine vil fremgå af produktresuméet og indlægssedlen.
Overvågning af sikkerheden efter vacciner er godkendt og taget i brug
Overvågningen af en vaccine stopper aldrig, så længe vaccinen er i brug. Det gælder for al medicin. Overvågningen starter allerede ved de første tidlige forsøg i laboratoriet og i dyreforsøg, og den intensiveres under forsøgene med mennesker. Forsøg på mennesker, også kaldet kliniske forsøg, er inddelt i tre faser, så sikkerheden kan kontrolleres tæt og på forsvarlig vis.
Lægemiddelstyrelsen registrerer, overvåger og vurderer løbende indberetninger om formodede bivirkninger i Danmark. Indberetninger vedrørende nye lægemidler og vacciner overvåges særligt nøje. Det gælder også for covid-19-vaccinerne, som Lægemiddelstyrelsen har forberedt sig særligt på, fordi mange er blevet vaccineret inden for en relativt kort periode.
Læger, tandlæger, behandlerfarmaceuter og jordemødre skal de første to år, efter vacciner eller anden ny medicin er taget i brug, indberette alle formodede bivirkninger (bortset fra formodede bivirkninger som følge af medicineringsfejl) hos patienter, som de har i behandling eller har behandlet, til Lægemiddelstyrelsen. Herefter er det alene formodede alvorlige eller uventede bivirkninger, der skal indberettes.
Andre sundhedspersoner, patienter og pårørende kan indberette alle formodede bivirkninger til Lægemiddelstyrelsen. Dette gælder for alle lægemidler, herunder også covid-19-vacciner.
Hvis du er sundhedsperson, kan du indberette formodede bivirkninger til Lægemiddelstyrelsen via Meld en bivirkning ved Covid-19-vaccine – for sundhedspersoner.
Vaccinerne overvåges i hele EU
Lægemiddelstyrelsen samarbejder med bl.a. de nationale lægemiddelmyndigheder i EU/EØS, Det Europæiske Lægemiddelagentur EMA og verdenssundhedsorganisationen WHO om overvågning af sikkerheden ved covid-19-vaccinerne.
Lægemiddelmyndighederne og vaccineproducenterne indberetter formodede bivirkninger til EMA, hvorfra der er adgang til indberetninger om formodede bivirkninger set i hele EU/EØS og indberetninger om formodede alvorlige bivirkninger set i tredjelande. Lægemiddelstyrelsen overvåger og vurderer i samarbejde med de andre europæiske lægemiddelmyndigheder, om der er signaler om nye eller ændrede risici ved vaccinerne i den europæiske bivirkningsdatabase.
Der bliver også foretaget fælles europæiske vurderinger af sikkerheden ved vaccinerne i forbindelse med periodiske sikkerhedsopdateringer, der skal indsendes af vaccineproducenterne med fastsatte intervaller. Her vurderer fageksperter fra lægemiddelmyndighederne i EU-landene, om der er nye oplysninger, der f.eks. gør, at der bør justeres i indlægssedlen. Herefter tager EU-Kommissionen stilling til, hvad der skal ske.
Når du bliver vaccineret mod covid-19, nedsætter du risikoen for selv at blive smittet og blive syg.
På nuværende tidspunkt er der ikke videnskabelig dokumentation for, at de godkendte covid-19-vacciner kan medføre senfølger i form af bivirkninger, der opstår lang tid efter vaccination. Der er heller ikke rejst signal i den europæiske bivirkningskomité (PRAC) om mulige senfølger i form af bivirkninger, der opstår lang tid efter vaccination.
Sådan bør du forholde dig, efter du er blevet vaccineret
Milde forbigående bivirkninger er almindelige efter vaccination og oftest helt ufarlige. Det kan fx være ubehag og rødme ved indstiksstedet, feber og muskelømhed. Du behøver ikke at tage fat i din læge, hvis du oplever den slags. Hvis du fx får let feber, er det udtryk for, at immunsystemet reagerer.
Kontakt din læge, hvis du oplever alvorlige symptomer
Hvis du oplever alvorlige symptomer, efter du er blevet vaccineret, bør du kontakte din læge. Det kan f.eks. være allergiske symptomer som vejrtrækningsbesvær eller hududslæt. Lægen kan vurdere, om symptomerne kan skyldes vaccinen eller evt. andre forhold.
Din læge har pligt til at indberette formodede bivirkninger ved covid-19 vacciner til Lægemiddelstyrelsen. Du kan i øvrigt kontakte din læge, hvis du er i tvivl om, hvorvidt du har fået bivirkninger efter vaccination.
Du eller dine pårørende kan selv indberette formodede bivirkninger til Lægemiddelstyrelsen via Meld en bivirkning ved covid-19-vaccine - for borgere